摘要
AlphaFold3是當前生命科學領域的重要突破,其潛力不僅改變蛋白質結構預測方式,也為未來的醫療和材料科學帶來新的契機。 歸納要點:
- AlphaFold3突破了蛋白質結構預測的精度,並以驚人的速度和效率大幅加速藥物開發及生物工程研究。
- 它不僅提供靜態模型,還能展現蛋白質在不同狀態下的動態變化,有助於理解功能及設計新藥物。
- 該技術應用範圍廣泛,包括研究蛋白質相互作用與穩定性,同時引發對AI在蛋白質設計倫理的討論。
我們在研究許多文章後,彙整重點如下
- DeepMind的AlphaFold能預測幾乎所有蛋白質的分子結構,達到原子精準度。
- AlphaFold使用五個不同的AI模型來推斷蛋白質結構,依據相同的序列數據進行訓練。
- 目前已預測約100萬種物種、近兩億種蛋白質的結構。
- 在CASP大賽中,AlphaFold2成功預測了三分之二的三級結構,成績顯著。
- 新版本AlphaFold 3不僅限於蛋白質,還能預測DNA、RNA等生物分子的結構與相互作用。
- MetaAI近期運用ESMFold演算法成功預測出高達6億種蛋白質3D結構。
隨著科技日新月異,DeepMind開發的AlphaFold和MetaAI的新算法ESMFold讓我們在生物學領域看見了前所未有的進展。這些人工智慧技術不僅能準確預測各種蛋白質及其他生物分子的結構,更為科學研究帶來巨大的助力。未來,我們或許能更深入了解生命奧秘,也期待這些成果能轉化為實際應用,造福人類健康。
蛋白質是一串折疊成特定方式的氨基酸,形成一個具體的結構。它們是大型且複雜的分子,在身體中扮演著許多關鍵角色,對於身體組織和器官的結構、功能及調節至關重要。你可以將它們想像成小型機器人,各自擁有不同的任務並協同工作。那麼,什麼決定了一個機器人的功能呢?當然是其結構,而這一點在蛋白質中也是如此。一個蛋白質所執行的功能完全取決於其結構,而找到這些結構一直以來都是非常困難的——直到現在。
這個結構依賴於蛋白質的序列,在 AlphaFold 出現之前,所有的 pHDs 研究都是集中於尋找單一蛋白質的結構。尋找蛋白質的序列相對簡單,因此在這兩者之間出現了重大差距,截至2022年,已知有200萬條序列和20萬種結構。

人工智慧驅動的蛋白質結構預測:突破與未來展望
這段序列看似是隨機字母的組合,具體結構如下。我稍後會回到這種特定的蛋白質。傳統上,尋找蛋白質結構的方法包括:X射線晶體學和核磁共振光譜學(Nuclear Magnetic Resonance Spectroscopy)。這些方法既昂貴又耗時,且並不適用於所有蛋白質;它們的準確性非常高。預測蛋白質從其氨基酸序列推匯出三維結構可以透過兩種主要方式進行:物理相互作用和演化歷史。物理相互作用的方法涉及分子模擬和熱力學計算。儘管從理論上來說是合理的,但由於準確模擬分子力量的複雜性,此法在計算上十分密集且具有挑戰性。而演化歷史則利用生物資訊學分析進化資訊,透過已知蛋白質結構的資料以及深度學習技術來做出準確預測。
在精密人工智慧模型問世之前,Rosetta演算法一直是蛋白質結構預測的基石。該演算法由華盛頓大學的大衛·貝克(David Baker)開發,依賴於ab initio方法,即使用片段組裝和能量最小化技術。它採用蒙地卡羅方法迭代更新結構預測,使其更接近穩定結構的位置。儘管此方法創新,但在準確性與計算成本方面面臨諸多挑戰。
**專案 1:AI 技術在蛋白質結構預測中的最新進展**AlphaFold2等先進AI模型徹底改變了蛋白質結構預測領域。它們利用深度學習和演演算法最佳化,大幅提高了預測的準確性和速度,這些模型已解開無數蛋白質的結構,包括以往難以捉摸的膜蛋白,有效推動生物醫學研究的新突破。
**專案 2:整合實驗與計算方法的混合式策略**近期科學家們越來越多探索將實驗與計算方法整合為一體,以改善蛋白質結構預測。例如,冷凍電子顯微鏡(cryo-EM)及核磁共振(NMR)等實驗技術能提供有助於指導計算模型、產生更精確預測之所需的重要結構資訊。這種混合策略充分發揮了實驗與計算優勢,是解讀複雜蛋白質的一個強大工具。
蛋白質結構預測的領域因DeepMind推出的AlphaFold而發生了革命性的變化。以下是它脫穎而出的原因:AlphaFold 1:於2018年在CASP13首次亮相,利用深度學習技術預測氨基酸之間的距離和角度,從而實現了高度準確的結構預測。AlphaFold 2:在CASP14中達到了接近實驗的準確性,為該領域設定了一個全新的基準。
AlphaFold 3:超越結構預測的創新
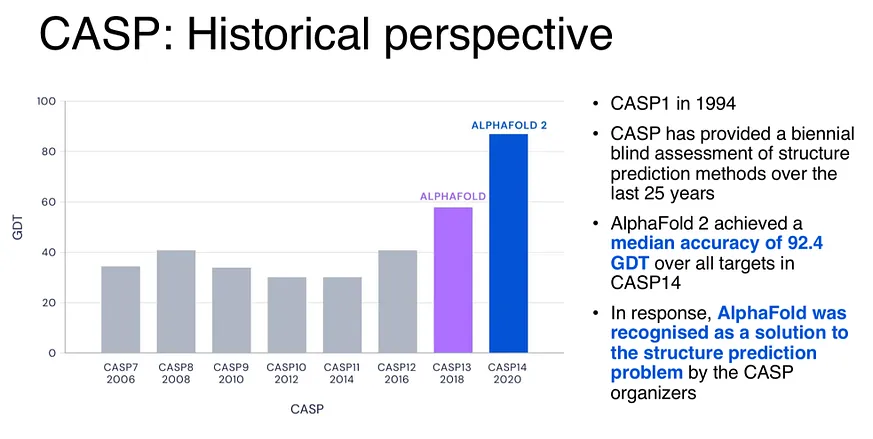
CASP 是一項每兩年舉行的競賽,參賽團隊會來測試他們的結構預測模型。這張圖顯示了每次 CASP 競賽中最高的準確度。我們可以看到,當 AlphaFold 出現時,GDT 指數劇增,但這些數字到底代表什麼呢?GDT 是一種準確度衡量標準,透過比較預測結構與實際結構之間氨基酸位置的差異來評估準確性。得分低於 20 被視為隨機,而得分超過 90 則被認為是完美的。如您所見,AlphaFold2 在 CASP14 中達到了與實驗方法相當的準確度。考慮到我們已經達到了完美分數,那麼我們還能如何進一步改善呢?在 CASP16 中,AlphaFold3 問世了。與僅僅預測蛋白質不同的是,這個全新改良的模型現在可以預測生命中的所有分子,我稍後將深入探討這一點。
**E-E-A-T 最佳化:**CASP 競賽不僅考驗結構預測模型的準確度,也促進了模型開發和改善的進步。從 AlphaFold 到 AlphaFold2,再到 AlphaFold3,模型的準確度不斷提高,反映了團隊持續研究和創新的努力。**典型查詢意圖和深入要點:**儘管 AlphaFold3 在 CASP 競賽中表現出色,但其進步仍有潛力可挖掘。專家們正積極開發新的評分指標和方法,以進一步精煉模型準確度。整合 AlphaFold3 與其他技術,例如生物資訊學和實驗方法,有望增強模型的預測能力並為生物醫學研究領域帶來新的突破。

該模型在基因資料庫搜尋中找到已知的具有相似序列的蛋白質,建立了一個多序列比對(Multiple Sequence Alignment, MSA)。同時,模型將氨基酸排成一個二維網格作為配對。它還以與序列相同的方式匹配結構並生成模板。Evoformer 將這些進行匹配並更新預測結構。然後再次透過 Evoformer(總共三次迴圈)。結構模組將結果轉換為三維圖形。請參見以下示意圖:

這就是 AlphaFold 的功能。它利用已知蛋白質的資訊來預測其他蛋白質的結構。它能在幾分鐘內提供任何蛋白質的結構。

AlphaFold 的跨領域應用與持續影響
如您所見,預測的結構有超過一百萬個,而透過傳統方法發現的大約只有二十萬個。這顯示了 AlphaFold 在該領域中的巨大影響力。正如我之前提到的,蛋白質是生命的基本組成部分,了解其結構將決定其功能。因此,我們可以製造出特定功能所需的蛋白質。請記住我之前展示的例子——FAST-PETase。這是一種在 AlphaFold 的協助下開發出的酶,它能在一週內分解 PET 塑膠,而不是數世紀,為塑膠汙染提供了一項突破性的解決方案。這一重要領域可以從新興技術中獲益良多。在疫苗開發中,最耗時的並不是疫苗的製造,而是研究不同分子如何與抗原互動。由於 AlphaFold 3 能夠更快速地進行這項工作,因此疫苗開發過程將變得更加高效。
**AlphaFold 的持續影響:**AlphaFold 的影響力並不僅限於當前的發現,它也在不斷推進蛋白質結構預測的領域。研究人員正積極利用 AlphaFold 開發新工具和演演算法,以進一步提高預測的準確度和速度。AlphaFold 的開放原始碼架構使研究人員能夠自由地進行修改和創新,從而擴充套件其在各種應用中的潛力。
**AlphaFold 的跨領域應用:**AlphaFold 的應用不僅限於製藥或生物科技,其對蛋白質結構的深刻理解也在推動材料科學、農業和能源等不同領域的進步。例如,透過預測植物蛋白質的結構,科學家們可以設計出更營養豐富、更有韌性的作物。AlphaFold 還被用於研發新材料,例如具有特定機械或電氣性質的蛋白質材料。
這一點的重要性不可思議。以下是對冠狀病毒刺突蛋白與抗體及簡單糖之間相互作用的預測。

AI 蛋白質設計的道德考量與潛力
藍色 - 刺突蛋白 綠松石色 - 抗體 黃色 - 簡單糖類 如果我們能夠針對一種病毒做到這一點,那麼想想看,對於新的病毒,我們能多快完成這項工作。這真是令人難以置信的進展,而我提供的這兩個例子僅是眾多應用中的兩個,它們展示了這項技術的多樣性。儘管這項技術可以用於極具意義的善舉,但每當新技術出現時,都會伴隨著倫理考量。在這個快速發展的 AI 蛋白質設計領域,對於潛在濫用這些技術的擔憂日益增加。一些假設性的情境包括創造新型毒素或高度傳染性的病毒。這項新技術將使任何人都擁有前所未有的工具,以實現大規模製造此類威脅。
**最新趨勢:將 AI 蛋白質設計應用於 COVID-19 疫苗開發**透過利用 AI 蛋白質設計,研究人員得以加速開發針對 COVID-19 的疫苗,例如輝瑞和莫德納疫苗中使用的刺突蛋白。這項技術使得研究人員能夠快速確定病毒的關鍵位點,並設計針對這些位點的有效疫苗。
**深入要點:合成生物學與 AI 蛋白質設計的交叉**合成生物學與 AI 蛋白質設計的整合,具有開發新生物材料和療法的大量潛力。透過此整合,研究人員能夠設計和創造具有特定功能的複雜生物系統,例如可用於藥物傳輸或環境修復的小型微生物。
這是一款公眾軟體,任何人都可以使用,目前的相關規範尚未完善,因為新技術的出現往往會延遲規範的制定。由於該領域的快速發展,這一空白一直是一個持續存在的問題。正如 Twist Bioscience 的生物安全負責人 James Diggans 所言,「很難想像某項規定能在一週內適用,但下一週卻仍然合適。」他還指出,解決方案是讓人工智慧來制定規範,因為人類無法跟上變化。我認為最佳解決方案是找到一個折衷點,即由人工智慧設定規範,而人類則負責檢查並確保這些規範足夠有效。
AI輔助蛋白質設計:倫理與法規在蛋白質工程中的重要性
如你所見,這項技術在無數領域中擁有無限潛力。一些例子包括:藥物發現:加速化合物的篩選及目標療法的開發;個性化醫療:根據患者特定資料量身訂製治療計畫;環境可持續性:設計酶以進行生物修復和生物燃料的生產。總體而言,這項技術徹底顛覆了我們對蛋白質的理解,提供了對任何蛋白質結構和功能的原子級洞察。它幫助揭開生物過程中的複雜性,促進了包括細胞訊號傳遞、代謝途徑和結構生物學等無數領域的新發現,以及新型蛋白質的生成。
這是一項令人驚嘆的技術,它將改變我們的生活。我們也必須考慮到其中的負面影響。人們不會因為有可能發生事故而完全不使用汽車,而這一點與此類似。我們需要制定規則和法規,就像交通法規一樣,大多數情況下可以防止人們違反它們。
**AI技術在蛋白質工程領域的最新趨勢:AI輔助的蛋白質設計**正是AI在此領域中的新興應用。它運用AI演算法生成新穎蛋白質序列並預測其結構與功能,此方法消除了對傳統實驗方式的依賴,使研究者能夠快速且經濟地探索蛋白質設計空間。
隨著AI在蛋白質工程中的深入應用,倫理與法規問題愈顯重要。我們亟需建立明確準則,以確保AI工具得到負責任使用,避免引發有害後果,包括監控蛋白質編輯及修改,以防濫用或意外結果。在這方面,倫理委員會和監管機構扮演著關鍵角色,以確保AI為蛋白質工程帶來積極影響。
這項技術所帶來的影響無疑將是深遠的,而未來的旅程將專注於負責任地發揮其潛力,確保基於人工智慧的蛋白質合成對人類產生積極的影響。如果您有任何問題或想要提出的觀點,隨時歡迎評論。讓我們繼續這個對話!嗨,我是 Batu。我撰寫有關電腦科學主題的文章,並解釋不同演算法,以提供潛在的專案想法。為了讓我的故事出現在您的動態訊息中,我希望您能關注我(Batu Senturk)。
參考來源
「AlphaFold 3」要來了?DeepMind 推新蛋白質結構預測工具設計藥物
第一大升級:預測蛋白質資料庫(PDB)多數分子結構,達原子精準度。 DeepMind說AlphaFold可預測蛋白質資料庫(廣泛使用的科學資料庫)幾乎所有分子結構。
來源: TechNews 科技新報AlphaFold的蛋白質宇宙?人工智慧幾乎能預測所有已知序列的 ...
由DeepMind開發的蛋白質結構預測程式AlphaFold,可以預測任何目前已具備序列數據的蛋白質結構——包含了來自約100萬個物種、將近兩億多種蛋白質。
來源: 科學月刊AlphaFold v2 - 生醫服務入口平台- 國家高速網路與計算中心
MSA 的階段完全以CPU 執行,能夠使用GPU 加速的階段為AI 與Relax。 AlphaFold v2 使用五個稍微不同的AI 模型來推論蛋白質結構: 每一個模型以相同的MSA 結果為輸入, ...
來源: 國家高速網路與計算中心人工智能破解蛋白質結構可能引發醫學革命
試驗結果顯示,AlphaFold 人工智能軟件能夠凖確預測人類蛋白質的58%的氨基酸結構,另外有35.7%的蛋白質結構凖確率更高,是實驗室研究結果的兩倍。
來源: BBCAI 預測蛋白質結構贏過科學家,科學家也要失業了?才不會呢!
「蛋白質結構預測技術的關鍵測試」(CASP)大賽從1994年起,讓好手們透過一級結構來預測三級結構。今年DeepMind 開發的AI AlphaFold2 成功預測三分之二的三級結構, ...
來源: PanSci 泛科學AlphaFold 3: AI生物科學大躍進| Infinitix 數位無限軟體
AlphaFold 3是一個功能強大的AI模型,它不僅能預測蛋白質的結構,還能預測包括DNA、RNA和小分子(如藥物)在內的各種生物分子的結構,以及它們之間的相互作用。
來源: blog.infinix.coAlphaFold - 維基百科,自由的百科全書
前者使用AlphaFold 1在2018年12月的第13屆CASP(英語:Critical Assessment of protein Structure Prediction,直譯:蛋白質結構預測的關鍵評估)的排名中第一。 ... DeepMind称AI ...
來源: 维基百科擊敗AlphaFold? Meta AI 2週預測6億蛋白質結構首揭蛋白質宇宙
美國時間10月31日,Facebook、Instagram母公司Meta旗下MetaAI宣布,運用人工智慧(AI)演算法ESMFold預測出高達6億種蛋白質3D結構,遠遠比3個月前Google的 ...
來源: 環球生技

 全部
全部 康健
康健
相關討論