摘要
本文深入探討人工基因合成中的最新趨勢,特別是如何有效組裝 DNA 序列,這對於生命科學研究和應用至關重要。 歸納要點:
- 近年來,多重 Golden Gate Cloning 和模組化技術的發展,顯著提高了大規模 DNA 組裝的效率。
- CRISPR 技術的引入,使得彈性門複製方法(如 Gibson Assembly)在精準度和效率上有了革命性的提升。
- 酵母組裝技術結合 CRISPR-Cas 系統,進一步優化了基因構建過程,推動合成生物學的快速進展。

在基因工程的過程中,我們的目標是將一種生物體的基因轉移到另一種生物體上。我們需要分離並擴增所需的基因(透過 PCR 技術),然後將其放入一個二元載體中,以便將這個基因傳遞到目標生物的組織中。分子克隆是一種將基因(或多個基因)插入二元載體的方法,此二元載體是一種經過改造以便插入基因的圓形細菌 DNA。由於單獨的基因無法直接送入任何植物或動物細胞,因此這一步驟有助於我們希望傳遞的基因進入目標生物。
我們在研究許多文章後,彙整重點如下
- 基因合成技術透過化學合成鹼基對,能夠不受傳統DNA合成的5`到3`方向限制。
- DNA組裝是基因合成的重要步驟,其效率受到連接效率和拼接次數的影響。
- 金斯瑞的GenBrick™技術可一次性準確有效地組裝多個DNA片段,大幅節省時間與成本。
- 人工合成完整支原體基因組是重要的科學突破,支原體為已知最小生物體,非常適合用於研究。
- 合成生物學利用工程方法設計改造基因和生物元件,而DNA組裝技術則是實現這些目標的關鍵工具。
- 芯宿生物優化了從DNA合成到基因拼接的一整套產業鏈,提高了基因合成的效率。
隨著科技進步,基因合成技術正逐漸改變我們對生命科學的理解。透過創新的方法,我們可以更快速、更精準地構建生命所需的基本單位。不僅如此,這樣的發展也讓研究人員能夠探索之前無法觸及的新領域。未來,我們期待這些技術能帶來更多生物醫療上的突破,甚至可能有助於解決一些全球性的健康問題。
在探討分子克隆的主題時,我將使用一些術語和概念,例如 PCR、寡核苷酸和引物,這些我已經在第一部分中進行了定義。因此,如果你還沒有檢視過那一部分,我建議你先去看看,以便更好地理解我們今天將要討論的內容。

Golden Gate Clonig 的最新趨勢:超大規模組裝
分子克隆是一個廣泛的術語,它描述了用於將 DNA 片段連線在一起以構建基因組合的所有方法。雖然有四種知名的分子克隆技術,但我們將重點放在兩種最受歡迎的技術上:Golden Gate Cloning(黃金門克隆)和 Gibson Assembly(吉布森組裝)。在深入探討這些科學之前,值得一提的是,這個方法是以金門大橋命名的。這個比喻強調了它能夠像大橋連線兩塊土地一樣,無縫地連線多個 DNA 片段。
讓我們開始吧!在 Golden Gate Cloning 中,DNA 首先會使用酶切割到外源基因將要新增的位置,產生“黏性末端”(見圖1)。這些黏性末端是從雙鏈 DNA 序列末端突出來的單鏈膨脹部分。如果兩個 DNA 片段的黏性末端具有相應的鹼基對(A 對 T 和 C 對 G),它們將自然吸引彼此並形成氫鍵。因此,可以說黏性末端就是如此粘連。
**近期趨勢:超大規模 Golden Gate Cloning**近年來,超大規模 Golden Gate Cloning 技術應運而生,它採用大量標準化的 DNA 元件組裝,能夠同時組裝數百甚至數千個 DNA 片段,大幅提升了複雜遺傳構建的效率和準確性。**深入要點:黏性末端的設計**黏性末端的設計是 Golden Gate Cloning 技術的關鍵。透過使用不同的限制性內切酶,可以產生具有不同序列的黏性末端。這種設計策略允許研究人員組裝具有特定順序和方向性的 DNA 片段,從而實現靈活且高效的遺傳構建。
總之,在當今基因工程領域中,不論是透過 Goldent Gate Cloning 還是其他技術,都展現出前所未有的重要性與潛力,使得科學家們可以更精準地操控生命體中的遺傳物質。

CRISPR 技術提升彈性門複製的精準度
但粘性末端究竟是如何形成的呢?酶是一種專門加速新陳代謝過程的蛋白質。這個廣泛的類別中有一位明星——限制酶,它像極為精確且可預測的剪刀,能在特定的 DNA 序列上進行切割。限制酶攜帶著預定義的 DNA 序列,尋找與之匹配的序列,當它們找到時,就會發出“咔嚓”的聲音。限制酶可以透過兩種方式切割 DNA,分別產生平頭和粘性末端。產生平頭(如 EcoRV)的限制酶意味著它直接穿透 DNA 的兩條鏈,而生成粘性末端(如 EcoRI)的則在每側留下幾個核苷酸的突出部分。後者正是進行彈性門複製所需的限制酶。
具體說明近期進展:研究人員已開發出新的 CRISPR-Cas 技術,可針對特定 DNA 序列執行更精準的剪下,並生成具有特定粘性末端的 DNA 片段。這項技術提高了彈性門複製的效率和靈活性。
深入要點:特定限制酶產生粘性末端的機制與 DNA 的螺旋結構有關。當限制酶識別並結合到靶序列時,它偏向於在具有區域性結構差異的 DNA 鏈上進行剪下,使得切口處生成單鏈核苷酸延伸,從而形成粘性末端。

但實際上,將你希望連線的兩段 DNA 片段製作成黏性末端並不僅僅是使用相同的限制酶那麼簡單。畢竟,兩個完全不同的基因不太可能擁有相同的鹼基對序列,讓你能夠插入限制酶來進行切割和連線。
CRISPR-Cas9、CAD 工具:基因連線中的利器
當我們嘗試將從 PCR 中分離出來的基因連線到一個二元載體時,這個二元載體將擁有由限制酶建立的粘性末端,而對應的突出部分則必須新增到獨立的基因上。在此之前,我們必須確保這兩個片段之間有重疊區域。這可以透過編輯引物來實現,引物是我們在前一篇部落格中提到的短小單鏈 DNA 片段。例如,如果二元載體上的粘性末端是 ′TTAA′,那麼我們可以在引物上製作一個 ′AATT′ 的突出部分,因為它們是互補的,因此能夠與二元載體連線。值得注意的是,這個引物所附加的基因序列實際上並不是 ′AATT′——如圖 3 所示,它實際上是 ′CAAT′。透過對引物進行這樣的修改,我們有效地將該基因的末端編輯成了一個可用作粘性末端的片段!在基因連線中,**CRISPR-Cas9 技術** 是一種強大的工具,可以透過設計引導 RNA 序列精確定位和修改目標基因,使得連線操作變得更簡便。同時,**計算機輔助設計(CAD)工具** 也發揮了重要作用,它幫助研究人員設計和最佳化基因連線策略,可以分析並預測粘性末端相容性,有效提高了整個過程中的效率和準確度。

最佳化黏性末端連線和 DNA 連線酶以提高載體組裝效率
由於 PCR 僅產生雙鏈平端,因此在 PCR 結束時我們不會得到黏性末端,而是得到一段具有重疊片段的基因。為了建立黏性末端,我們必須使用限制酶在這個編輯過的末端進行切割,方法與之前討論的一樣。現在,在二元載體和外來基因的匹配黏性末端自然結合後,黃金門組裝(Golden Gate Assembly)只剩下一步。如我下面美麗的圖示(圖4)所示,雖然兩個片段之間的垂直鹼基對已經連線,但橫線之間突出的區域(糖和磷酸骨架)仍然是分開的。此時,酶 DNA 連線酶便派上用場,以填補這些空隙。只有在這一步完成後,連線才算安全。(如果你想知道,DNA 連線酶也可以直接將兩個平端 DNA 片段連線起來;不過,由於沒有突出部分可用於對齊這兩個 DNA 分子,所以效率較低。)
**專案 1:黏性末端連線的效率最佳化**研究發現,透過使用具有高保真度和特異性的限制酶,以及最佳化的緩衝液條件和孵育溫度,可以顯著提高黏性末端連線的效率。這些技術改善了限制酶切割和 DNA 片段配對的精確度,減少了錯配和副產物的產生。**專案 2:DNA 連線酶的選擇和最佳化**DNA 連線酶型別及其反應條件也會影響最終產品的質量與產率。因此,目前研究者正在開發新的 DNA 連線酶,以提供更高活性、更佳保真度以及對各種 DNA 末端型別更強韌性的耐受能力。透過最佳化反應緩衝液組成、孵育時間與溫度等引數,也能有效提升最終產品的產量與質量。
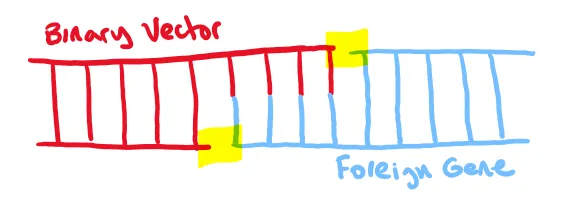
這就是結束了!金門大橋克隆是一種高效且精確的分子克隆方法,因其結構的特性,也可以用來一次性連線多個基因,只要每一個粘性末端與下一個基因對應即可。

接下來,我們來看看 Gibson 組裝!這種方法的運作策略與連線對應的黏性末端相同,但其製作過程卻完全不同,並且在將各部分連線在一起時還多了一個步驟(連結)。下圖(圖 6)是我學習這一過程時恍然大悟的關鍵,所以讓我們一起詳細了解一下。

在 Gibson 組裝中,DNA 片段末端的要求有所不同。在這裡,我們使用的是平端的二元載體(紫色)和外源基因(青色)。我們仍然需要在末端有重疊的基因序列(黃色和紅色),以便兩個片段能夠在正確的位置對齊並連線。這些同源區域是透過 PCR 技術製作的,在此過程中,外源基因的引物延伸至與插入點兩側的二元載體前15至40個鹼基配對。

我已經介紹瞭如何像金門大橋克隆技術一樣,利用 Gibson 組裝技術將 DNA 序列透過黏性末端連線起來。但現在我們面臨一個問題:當兩個 DNA 片段具有平端時,我們該如何將這些平端連線在一起呢?其實,在 Gibson 組裝中,黏性末端是由 5′(五號)外核酸酶生成的。
讓我們來解析這個術語:“5′”表示它從雙鏈 DNA 分子的 5′ 端開始,朝著 3′ 端進行(見圖8)。“Exo”定義了它如何在 DNA 分子外部或於末端運作,相對於“endo”,後者則是指從 DNA 分子的中間進行操作(例如,限制酶和 CRISPR)。而“Nuclease”代表“核苷酸”,意味著這是一種降解 DNA 的酶,它會“啃食” DNA 鍊,留下不連線的單個核苷酸。綜合而言,“5′ 外切核酸酶”可以解釋為“一種能夠從雙鏈 DNA 分子的 5′ 端移除核苷酸的酶。”
或者說,“去除”這個詞可能太過於溫和——這種酶在雙鏈DNA片段的每一側猛烈地侵蝕著一條鏈,排出多達80個核苷酸,從而創造出極長的粘性末端。
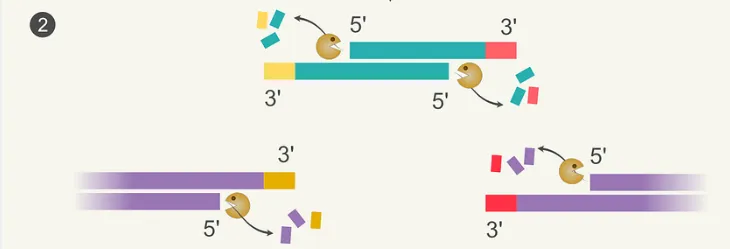
在這些過於冗長的黏性末端中,只有由引物定義的 15–40 bp 的同源材料是匹配的。因此,這些是片段對齊的位置——它忽略了被外切酶消耗掉的其他核苷酸。因此,我們現在得到了一個連線但非常不完整的 DNA 分子。

為了填補這些空白,我們來重拾 DNA 聚合酶!它們正是那些在 PCR 過程中收集核苷酸並構建新序列的角色。在這裡,它們扮演著非常相似的角色。這些聚合酶附著在面對不完整片段的 3′ 端,收集周圍溶液中漂浮的核苷酸,並按照現有互補鏈所排列的序列將其串連起來。當它們到達外切酶停止的位置,而核苷酸仍然連線時,它們就會脫離,完成了自己的任務。

就像在金門克隆(Golden Gate Cloning)中,DNA 連線酶(DNA ligase)被用來將核苷酸連線後的糖/磷酸骨架相連一樣,現在同樣需要它來達成這個目的。之後,我們就能將所需的基因無縫地整合進二元載體中!這就是吉布森組裝(Gibson Assembly)的全部過程。

是的,酵母,就是那種讓你的麵包發酵、啤酒釀造的微小真菌。這種隱形的生物棲息在你的廚櫃中,卻擁有隱藏的才能,使它成為生物技術中的珍貴工具!
CRISPR-Cas 加持酵母組裝技術,提升合成生物學效率
酵母組裝的創新分子克隆技術充分利用了酵母自我修復 DNA 的天然能力。具體而言,這個系統能夠將外來 DNA 平滑且可靠地整合到其基因組中。這種方法稱為同源重組(homologous recombination),需要 DNA 片段之間擁有大面積的重疊同源區域,才能相互重組並插入所需的基因。基本上,它的運作方式與 Gibson Assembly 方法相似,但發生在酵母內部。因此,與 Gateway Cloning 中的重組不同,這裡並不要求片段必須有特定的位置或序列,只要有酵母存在即可。**最新趨勢:CRISPR-Cas 輔助下的酵母組裝**近年來,CRISPR-Cas 系統與酵母組裝技術相結合,進一步提升其效率和準確性。藉由利用 CRISPR-Cas 在特定序列上產生雙股斷裂,可誘導酵母進行同源重組,將外來 DNA 精準整合至目標位址,減少嵌合體產生的可能性。
**深入要點:酵母組裝技術在合成生物學中的應用**這項技術在合成生物學領域中扮演著關鍵角色,不僅允許科學家快速且可靠地組裝大型 DNA 片段,也透過利用酵母天然的 DNA 修復能力,使研究人員得以構建複雜的基因路徑和調控網路。在推動新藥開發、生物燃料生產及工業酵素工程等領域方面,它展現出無可比擬的重要性。
酵母組裝:全基因體編輯和合成生物學的強大工具
儘管 Yeast Assembly 使用了與 Gibson 組裝相同的方法,但它有幾個顯著的不同之處。可以說,所有的一切都是……更大!與 Gibson 組裝所見的最高 80 bp 的突起相比,Yeast Assembly 中的外核酸酶會產生約 1,000 bp 長的大型突起!由此Yeast Assembly 更適合組裝非常大的 DNA 片段。這也帶來了一定的成本——為了讓酵母能夠完成這一過程,必須額外新增約 2,000 bp 的元件和基因。除了這一步驟帶來的不便之外,在生物技術領域一般規則是:DNA 的片段越長,其編輯效率和可靠性就越低。正因如此,各種不同的分子克隆方法應運而生——每一種都希望為特定情況提供理想解決方案,而作為科學家,我們必須做出選擇。**Yeast Assembly 的最新趨勢:應用於全基因組編輯** Yeast Assembly 近期在全基因組編輯領域取得顯著進展。透過整合 CRISPR-Cas9 技術,科學家可以利用 Yeast Assembly 進行高通量、高精度的大規模基因組修改,此方法可加速基因組工程研究,並有望應用於遺傳疾病治療。
**Yeast Assembly 的靈活性:擴充套件到合成生物學** Yeast Assembly 在合成生物學中展現出強大的潛力。其可組裝大型 DNA 片段的能力使其成為構建複雜生物系統的理想工具。透過 Yeast Assembly,科學家能夠設計和合成人工基因組,為生物設計和生物生產領域開創新的可能性。
分層組裝與生物正交化學:分子克隆新技術的前沿
限制酶克隆、Gibson 組裝及酵母組裝都是分子克隆中強大的工具:它們不僅精確且高效,還能同時連線多個基因,這些特性使它們成為首選。影響選擇這兩者之間的主要因素之一,是限制酶的結合位點的可用性。每種限制酶只能與一特定序列(4–8 bp)結合。一段基因序列可能缺乏適當的結合位點,或是有過多的結合位點——如果在基因中間出現了結合位點,則該限制酶會將其辨識並切割基因,使其斷裂為兩半,而這正是我們所不希望發生的情況。(雖然有方法可以移除這類問題性的結合位點,但往往會變得複雜且繁瑣。)限制酶結合位點的數量只是眾多可能導致偏好替代分子克隆技術因素之一。目前這四種分子克隆方法都是相當流行,但隨著此領域的不斷擴充套件,還有數十種其他成熟技術,也許未來會有數百種新方法被開發出來。例如,“**專案 1:分層 Gibson 組裝的興起**”提到了一種創新的分子克隆技術,它簡化了多基因片段的組裝。不同於傳統採用特定引物設計需求的 Gibson 組裝,分層 Gibson 組裝使用通用引物,使得快速組裝多個片段成為可能,同時避免了與限制酶位點相關的一系列困境。而在“**專案 2:生物正交化學在分子克隆中的應用**”中,我們看到生物正交化學技術,如轉移酶反應和自組裝方法,在分子克隆方面逐漸受到重視。這些技術提供了高度特異性和靈活性,使得在沒有限制酶位點或相容性末端條件下也能有效連線 DNA 片段。不僅如此,生物正交化學的方法不僅簡化了整體流程,更拓展了組裝複雜 DNA 結構的新可能性。
現在我們來到了人工基因合成的階段!從 PCR 和引子設計到各種分子克隆的方法,我們已經涵蓋了所有內容。設計一個包含令人興奮的新基因的二元載體只是製造轉基因植物的第一步。接下來,我們必須使用基因插入方法,將這個二元載體送入目標細胞,然後培養這些細胞直至長成完整的植物。這是一條漫長而激動人心的道路,誰知道在終點會等待你的是什麼呢?生物發光的花朵、紫色番茄,還是對抗氣候變遷的新工具?你說得出來就行!
參考來源
基因合成服務(Gene Synthesis)
基因合成是以化學合成鹼基對的方式合成重組DNA,不同於DNA和RNA合成酵素(Polymerase),基因合成並不受5'到3'合成規則的限制,可以合成5'到3'或3'到5'方向。
來源: 圖爾思生技DNA合成、组装与纠错技术研究进展
现有DNA合成技术的局限,使DNA组装成为基因合成不可或缺的过程。组装过程受连接效率和拼接次数影响显著。使用短初始片段组装染色体或基因组长度DNA所需的分层组装次数 ...
來源: 化学工业出版社DNA合成、组装与纠错技术研究进展
DNA设计合成是推动生命科学及其相关领域发展的关键共性底层技术。常规的遗传操作技术仅能对已有的DNA序列进行有限的改造,而DNA合成技术则可从头“书写”生命 ...
來源: 天津中合基因科技有限公司GenBrick™长片段基因合成
金斯瑞创新性技术-GenBrick™长片段基因合成,可准确有效地将多个DNA片段进行一步组装。相比传统的数个短片段DNA多次拼接及组装的方法,该技术大大节省了时间及成本。精准合成 ...
來源: 金斯瑞浅谈合成生物学之超大基因如何高效组装
... 人工合成了完整的支原体基因组(Fig.5)。支原体是已知最小的生物体,很适用于做基因组研究。这个首次被合成并且成功组装的超大DNA是丝状支原体基因组,它的全长有1.08M ...
來源: 金唯智合成生物学中的DNA组装技术
合成生物学旨在应用工程学. 的研究思路及手段去设计改造基因、生物元件、生. 物途径,甚至整个基因组;而DNA 组装技术则是实. 现合成生物学各种目的的关键 ...
來源: 中国科学院基因合成服务
芯宿生物打通了从DNA合成设备研发、合成原材料、合成工艺和方法到基因拼接和组装整个产业链条,充分的优化了基因合成的每一步生产环节。凭借专业的基因合成技术团队、完备的 ...
來源: atantares全基因合成-生工生物-生命科学产品与技术服务
人工合成基因是根据DNA序列设计引物,通过PCR扩增等方式获取目的序列,将目的序列 ... 生工生物可提供简单基因的合成、改造等片段基因合成,交付的线性双链基因片段可直接进行用 ...
來源: 生工

 全部
全部 康健
康健
相關討論